マイコトキシンが腸に与える影響
カビの症例について多くの開業医と話した経験から、腸の問題はカビにさらされた患者が経験する最も一般的なジレンマの一つであると断言できる。 そこで今日は、カビにさらされることが、腸に関連した複数の合併症を引き起こす可能性があることをお話ししようと思います。 私はこれまで、患者の症状に困惑している何百人もの医師にマイコトキシン検査を勧めてきた。何年もの間、私は検査結果からマイコトキシンに関連した病気を示唆する特定の「レッドフラッグ」に気づくようになった。
私がよく注目していた3つの兆候は、体内のグルタチオンの可用性、ミトコンドリアストレス、そして腸内マーカーだった。 この記事では、マイコトキシンの曝露が微生物叢、免疫系機能、腸透過性(栄養吸収に関わる)にどのように影響するかなど、有毒カビに反応して生じる可能性のあるいくつかの異なる腸の不調について触れる。
この20年間で、カビやマイコトキシンへの暴露と慢性疾患との関連性がますます明らかになってきた。 患者はさまざまな原因からカビ毒に接触する可能性があるが、最も一般的な2つの原因は、水害にあった建物(実際にカビ毒曝露事例の大半を占める)と食品である。 現在アメリカでは、食品産業はUSDA(米国農務省)によって厳しく監視されている。 (1) .
しかし、大規模なモニタリングのための資源を持たない発展途上国では、食品は重大なリスクとなりうる(2)。 しかし、発生源にかかわらず、マイコトキシンは通常、口(呼吸または摂取)または皮膚から宿主の体内に入る。 その後、マイコトキシンは血流に乗り、肝臓で濾過され、胆嚢に移動し、最終的に小腸に移動する。 最後に、マイコトキシンは胆汁酸トランスポーターを通して血液中に再吸収される(3)。 このように腸内を循環し続けることで、毒素が宿主に与えるダメージが増幅される。
体内の微生物叢は様々な場所に存在するが、最も大量に存在するのは消化管内である。 胃腸は、小腸や大腸(別名:結腸)など複数の曲がりくねった管からなり、胃から肛門まで続いている。 消化管は、栄養素を小さな要素に分解し、身体がエネルギー生産と成長に利用できるようにする役割を果たすことで最もよく知られている。 (4).
これらの機能は、微生物叢の努力によって実現されている。微生物叢は、腸と共生しているそれ自体が独立した臓器と見なせるほど複雑で、デリケートなシステムである(5)!腸内細菌叢は、細菌、真菌、ウイルスなど様々な種類の生物で構成されている。 また、腸内細菌叢は代謝や抱合を介して様々な分子を調節するため(6)、腸内細菌の多様性が健康状態の改善につながることは理にかなっている(7)。
マイコトキシンによって引き起こされる多くの問題のひとつに、微生物叢の恒常性の乱れがある。 ある研究では、オクラトキシンA(OTA)を異なる微生物叢と培養すると、ラクトバチルス・ロイテリがすべて消失することが実証された(8)。 ロイテリ 乳酸菌には抗炎症作用や免疫調節作用があり、下痢の予防にも役立つため、これは有害である(9、10)。 アフラトキシンはまた、微生物叢の系統的多様性を減少させる(11)。
カビ毒は免疫系に劇的な影響を及ぼし、ひいては腸にも大きな影響を及ぼす。 複数のマイコトキシンが免疫システムの阻害を引き起こし、他の病原体の侵入を許してしまう。 OTAは末梢TおよびBリンパ球の増殖を抑制する。 また、インターロイキン2とその受容体の産生も止める(12)。 さらに、OTAは体内でのインターフェロンの産生を阻害する(13)。 例えばイヌでは、OTAは脾臓とリンパ節の胚中心を減少させ、造血幹細胞を減少させるため、白血球総数が減少する(14)。
一方、マウスでは、OTAは成熟CD4+細胞の減少を引き起こす(15)。 これらの変化はすべて、感染と闘う身体の能力を大きく低下させる。 カビに暴露された患者は免疫力が低下しているため、腸疾患(腸の病気)を発症しやすい。 この種の感染症は、下痢、抑うつ、炎症、代謝障害、腹痛、その他の合併症として現れることがある(16)。 クロストリジウム(17)、大腸菌(18)、サルモネラ菌(19)、カンジダ(20)など、複数の種類の病原体が体内に侵入することもある。
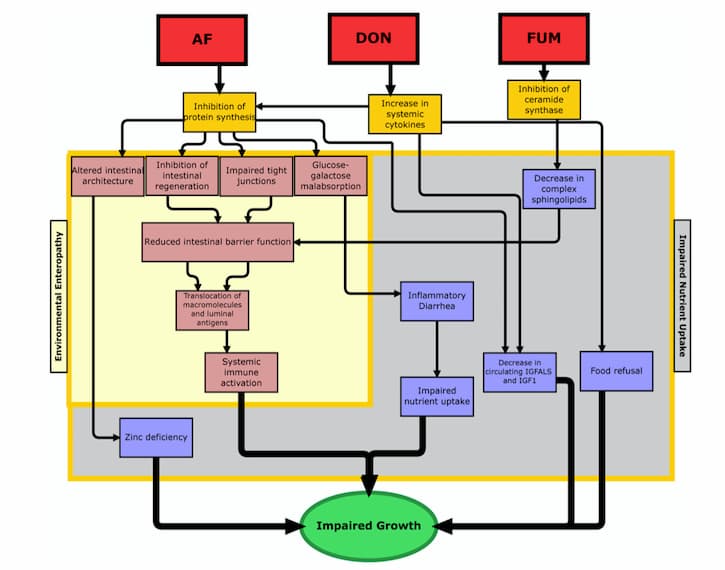
消化管は体内のさまざまな機能にとって非常に重要であるため、カビ毒によってダメージを受けると、多くの影響が出る可能性がある。 起こる可能性のある最も重大な障害のひとつは、腸管透過性の亢進であり、これは炎症の亢進、栄養吸収の損失、細菌の移動につながる(21, 22)。 マイコトキシンが具体的にどのようにして腸管透過性の亢進を引き起こすのかについては、まだ結論が出ていないが、この分野の専門家は、なぜこのようなことが起こるのかについて、いくつかの異なる考えを持っている。 有力な説のひとつは、マイコトキシンがタイトジャンクションタンパク質の阻害を引き起こすというものである(23)。 その他の原因として、誘発される酸化ストレス、腸管細胞の損傷(すなわち腸管吸収細胞の傷害)、スフィンゴ脂質代謝の乱れが提唱されている(24-26)。 結局のところ、これらの変化はすべて、身体の劇的な逸脱につながり、最終的には成長障害につながる(Smithらの図1参照)。
マイコトキシンと腸との相互作用は、さまざまな問題を引き起こす可能性がある。 そしてこれらの問題は、炎症の増加、感染症の併発、代謝障害、消化不良、栄養吸収障害につながる可能性がある。 だから、カビにさらされた患者がデトックス・プログラムに参加する場合、そのプログラムには腸を修復するための本格的な取り組みが含まれていなければならない!
1.S. H. Park, D. Kim, J. Kim, Y. Moon, Effects of Mycotoxins on mucosal microbial infection and related pathogenesis.Toxins (Basel) 7, 4484-4502 (2015).
2.L. E. Smith, R. J. Stoltzfus, A. Prendergast, Food chain mycotoxin exposure, gut health, and impaired growth: a conceptual framework.Adv Nutr 3, 526-531 (2012).
3.Z. Zhang ら、A systematic review of plant-conjugated masked mycotoxins:発生、毒性、代謝。Crit Rev Food Sci Nutr 60, 1523-1537 (2020).
4.N. Menche,Biologie Anatomie Physiologie., (Elseveier, Munich, 2012).
5.A.M.オハラ、F.シャナハン、忘れられた臓器としての腸内細菌叢。EMBO Rep 7, 688-693 (2006).
6.A. Visconti et al., Interplay between the human gut microbiome and host metabolism.Nat Commun 10, 4505 (2019).
7.A. Mosca, M. Leclerc, J. P. Hugot, Gut Microbiota Diversity and Human Diseases:生態系における主要な捕食者を再導入すべきか?Front Microbiol 7, 455 (2016).
8.M. Ouethrani 他、ヒト大腸の動的シミュレーターにおけるコーヒー汚染物質としてのオクラトキシン A の代謝運命。Food Chem 141, 3291-3300 (2013).
9.L. M. Rocha-Ramirez ら、Probiotic Lactobacillus Strains Stimulate the Inflammatory Response and Activate Human Macrophage.J Immunol Res 2017, 4607491 (2017).
10.K. J. Li ら、Dysbiosis of lower respiratory tract microbiome are associated with inflammation and microbial function variety.Respir Res 20, 272 (2019).
11.J. Wang, L. Tang, T. C. Glenn, J. S. Wang, Aflatoxin B1 Induced Compositional Changes in Gut Microbial Communities of Male F344 Rats.Toxicol Sci 150, 54-63 (2016).
12.T. Lea, K. Steien, F. C. Stormer, Mechanism of ochratoxin A-induced immunosuppression.Mycopathologia 107, 153-159 (1989).
13.A. Pfohl-Leszkowicz ら, ヒト腎症および尿路腫瘍におけるアリストロキア酸ではなくマイコトキシンの関与に関する新たな分子および現場での証拠.Mol Nutr Food Res 51, 1131-1146 (2007).
14.G. A. Boorman ら、オクラトキシンAに曝露したマウスにおける骨髄毒性とマクロファージの変化、Toxicol Appl Pharmacol 72, 304-312 (1984).
15.A. Thuvander, E. Funseth, A. Breitholtz-Emanuelsson, I. P. Hallen, A. Oskarsson, Effects of ochratoxin A on the rat immune system after perinatal exposure.Nat Toxins 4, 141-147 (1996).
16.S. G. Cheung ら、Systematic Review of Gut Microbiota and Major Depression.Front Psychiatry 10, 34 (2019).
17.G. Antonissen et al., The mycotoxin deoxynivalenol predisposes for the development of Clostridium perfringens-induced necrotic enteritis in broiler chickens.PLoS One 9, e108775 (2014).
18.A. Kumar 他、オクラトキシン A を給与し大腸菌を接種したブロイラー鶏の病理学的変化。Avian Pathol 33, 413-417 (2004).
19.J. H. Tai, J. J. Pestka, トリコテセンT-2毒素の経口曝露によるサルモネラ・チフスムリ ウムに対するネズミの抵抗性の低下。Food Chem Toxicol 26, 691-698 (1988).
20.P. B. Hamilton, J. R. Harris, Aflatoxicosis with Candida albicans infections and other stresses in chickens.Poult Sci 50, 906-912 (1971).
21.D. I.Campbell, M. Elia, P. G. Lunn, Growth faltering in rural Gambian infants is associated with impaired small intestinal barrier function, leading to endotoxemia and systemic inflammation.J Nutr 133, 1332-1338 (2003).
22.J. R. Kelly et al., Breaking down the barriers: The gut microbiome, intestinal permeability and stress-related psychiatric disorders.Front Cell Neurosci 9, 392 (2015).
23.J. McLaughlin, P. J. Padfield, J. P. Burt, C. A. O’Neill, Ochratoxin A increases permeability through tight junctions by removal of specific claudin isoforms.Am J Physiol Cell Physiol 287, C1412-1417 (2004).
24.S. Bouhet, E. Le Dorze, S. Peres, J. M. Fairbrother, I. P. Oswald, Mycotoxin fumonisin B1 selectively down-regulates the basal IL-8 expression in pig intestine: in vivo and in vitro studies.Food Chem Toxicol 44, 1768-1773 (2006).
25.Y. M. Abdulrazzaq, N. Osman, A. Ibrahim, Fetal exposure to aflatoxins in the United Arab Emirates.Ann Trop Paediatr 22, 3-9 (2002).26. G. Anderson, M. Seo, M. Berk, A. F. Carvalho, M. Maes, パーキンソン病における腸管透過性と微生物叢:パーキンソン病における腸管透過性と微生物叢:うつ病、トリプトファン異化物、酸化的およびニトロソ化ストレス、メラトニン作動性経路の役割。Curr PharmDes22, 6142-6151 (2016).
